Вакцины против свиного гриппа имеют сходство с вакцинами против гриппа у людей, но не полностью
Существующие на сегодняшний день коммерческие вакцины против свиного гриппа серотипа А (SwIV) в основном представляют собой традиционные инактивированные (или мертвые) вакцины для внутримышечной (в/м) инъекции. Такие вакцины защищают, индуцируя антитела против основного вирусного поверхностного белка, гемагглютинина. Слабой стороной этих нейтрализующих антител является то, что они нацелены на наиболее вариабельные части гемагглютинина. По этой причине штаммы в вакцинах против человеческого гриппа обновляются каждые несколько лет, чтобы соответствовать циркулирующим штаммам (Дормитзер и др., 2011)

Вакцины против свиного гриппа серотипа А (SwIV) схожи с мертвыми вакцинами для людей, но они также и существенно отличаются. В то время как человеческие вакцины обычно содержат очищенные поверхностные антигены вируса, без адъюванта, большинство вакцин против SwIV являются цельновирионными с масляным адъювантом. В отличие от человеческих вакцин, доза антигена и вакцинные штаммы не стандартизированы для вакцин против SwIV (Ван Рит и Ма, 2013). В соответствие с антигенными и генетическими различиями между SwIV в Европе и Северной Америке, вакцины для каждого географического региона производятся локально и содержат совершенно различные штаммы. Наиболее распространенные вакцины на европейском рынке - это трехвалентные вакцины, содержащие птичье подобный H1N1, человекоподобный H1N2 и H3N2 SwIV в комбинации с адъювант-карбомером примерно с 2000 года. Двухвалентная вакцина с масляным адъювантом также часто используется. Она основана на штамме птичье подобного свиного H1N1 и человеческого H3N2 изолированного более 35 лет назад. Подобные вакцины в США содержат репрезентативные штаммы до трех различных клеточных линий H1 SwIV и одной или 2 клеточных линий H3N2. Моно валентная вакцина, основанная на пандемическом вирусе H1N1 2009 года недавно запущена на обоих континентах.
Сложности при выборе штамма вакцины против SwIV
SwIV претерпел больше изменений, чем когда либо за последние десять лет, а отсутствие перемен в вакцинном штамме SwIV и рекомендаций стало важным вопросом. Хотя по существу все вирусы свиного гриппа получили свой гемагглютинин от вирусов, когда-то циркулирующих у людей, эпидемиология гриппа намного сложнее у свиней, чем у людей (Lewis и др, 2016). Множественный перенос вирусов гриппа от человека свиньям в различных странах и тот факт, что свиньи не перемещаются подобно людям, внесло вклад в огромное генетическое и антигенное многообразие вирусов свиного гриппа. Это проиллюстрировано на Рис. 1 для подтипа H3N2.
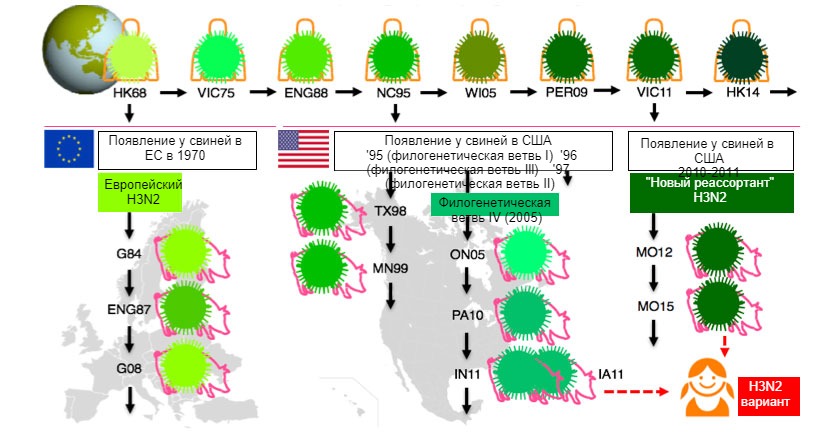
Fig 1. Evolution of H3N2 influenza viruses in humans and in swine. Different shades of green point to antigenic differences in the H3 HA; virus strains are indicated with the place (abbreviated) and year of isolation. Human viruses were introduced into the swine population in the early 1970s in Europe and in the mid 1990s and in 2010 in North America. Рис. 1. Эволюция вирусов гриппа H3N2 у людей и свиней. Различные оттенки зеленого указывают на антигенные отличия в гемагглютинине Н3; штаммы вируса показаны с указанием места (аббревиатура) и года выделения. Человеческие вирусы появились у свиней в начале 1970х в Европе и в середине 1990х и в 2010 в Северной Америке. Это привело к текущей циркуляции 3х различных филогенетических ветвей (см. блоки), одна в Европе, 2 в Северной Америке. Филогенетические ветви Северной Америки случайно вернулись к людям и теперь стали «вариантами» вируса.
Подтипы свиного гриппа H1N1 и H1N2 еще более многообразны. Три клеточных линии H1, циркулирующих одновременно во многих странах Европы: птичье подобный, человекоподобный и пандемический H1 2009 года. Аминокислотная последовательность из гемагглютинина различается на 20-25% и между ними существует минимальная серологическая перекрестная реактивность. Более того, превалирующие клеточные линии и филогенетические ветви (под классификации клеточной линии) отличаются в различных частях Европы, а в Северной Америке и Азии циркулируют другие филогенетические ветви.
Важно отметить, что в отличие от вакцин против человеческого гриппа многие из коммерческих вакцин против SwIV выказывают относительно широкую защиту против перемещающихся вариантов в указанных клеточных линиях H1 или H3. Это может быть объяснено наличием адъювантов в этих вакцинах, что увеличивает перекрестную реактивность иммунного ответа. Тем не менее, задача – как защитить свиней против многочисленной коциркуляции вирусов H1 и H3 из различных клеточных линий и филогенетических ветвей. Это может потребовать применение мультивалентных вакцин, состоящих, по крайней мере, из 5 различных штаммов свиного гриппа H1 и H3. Подходящие штаммы не только будут различаются в разных странах и регионах, но и потребуют регулярных обновлений. Такие поливалентные вакцины против SwIV сложны как с технической, так и с экономической точки зрения. Развитие вакцин, которые могут предложить более широкую перекрестную защиту клеточных линий и филогенетических ветвей может стать более предпочтительным подходом.
Гетерологическая прайм-буст вакцинация может предложить более широкую защиту, чем соответствующая поливалентная вакцина
Исследователи гриппа пытаются стимулировать иммунный ответ на части гемагглютинина, которые наименее всего меняются от штамма к штамму. Антигенные детерминанты в таких частях в большой степени игнорируются традиционными вакцинами и вакционными стратегиями так как они «субдоминантные». Один подход, кажущийся многообещающим, выбирает два сильно различающихся по антигенным свойствам штамма с подтипами Н1 и Н3 для первичной и вторичной вакцинации. Так как у этих штаммов небольшое перекрытие в самых вариабельных ключевых антигенных детерминантах, антитела, продуцирующие клетки будут перенаправлены на законсервированные субдоминантные антигенные детерминанты. Наша исследовательская группа в Гентском университете продемонстрировала потенциал данной «гетерологической прайм-буст» стратегии при изучении свиней с экспериментально инактивированной вакциной против свиного гриппа Н3N2. Чистым по гриппу свиньям сначала сделали инъекцию с европейским штаммом Н3N2, а затем 4 недели спустя штаммом Н3N2 из Северной Америки или наоборот, как показано на Рис 2.
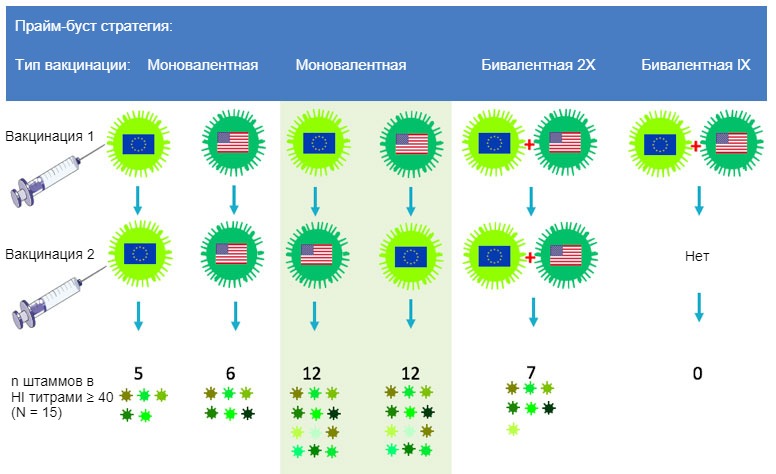
Рис. 2. Влияние традиционной и гетерорлической прайм-буст схем вакцинаций на спектр анти-H3N2 иммунного ответа. Европейские и Североамериканские штаммы свиного гриппа H3N2 указаны различными флажками. Плазма, отобранная спустя 14 дней после второй вакцинации, была протестирована против 15 антигенно отличных вирусов, включая вакцинные штаммы. Цифры показывают количество вирусов, против которых титры HI антител были ≥ 40.
Полученные антитела дали перекрестную реакцию с около 80% панели с 15 различными штаммами вируса H3N2 как человеческого, так и свиного происхождения, по сравнению с менее 40% в контрольной группе с гомологической прайм-буст вакцинацией (Ван Рит и др., 2017). Антитела против обоих вакцинных штаммов были обнаружены только после гетерологической прайм-буст вакцинации или после 2 инъекций бивалентной вакциной, содержащей оба штамма, но степень перекрестной реакции была намного больше в первых группах. Использование различных вакцин для первой и бустерной вакцинации не только кажется более иммунногенной, чем любая из существующих вакцин против SwIV, это также может сократить общее количество необходимых вакцин.
Важно, что не любая комбинация антигенно отличных штаммов свиного гриппа H3N2 и H1N1 хорошо сработают. Также, порядок введения вакцинных штаммов оказывает огромный эффект на иммунный ответ. В настоящий момент мы пытаемся вывести научную базу для этих наблюдений и в дальнейшем улучшить прайм-буст схемы как с вирусами H3N2, так и H1N1 и H1N2.

От эксперимента к практике
К сожалению, эффекты первичной и последующей вакцинации различными коммерческими вакцинами против SwIV пока не были изучены, и пока мы еще не можем рекомендовать определенные прайм-буст схемы для использования на практике. Данный альтернативный подход потребует либерального отношения со стороны вакцинаторов. Маловероятно, что одна прайм-буст схема будет подходить для животных всех возрастов. Хотя мы считаем, что несколько выбранных схем могут смягчить некоторые из самых серьезных препятствий эффективной вакцинации против SwIV. Вакцинация маленьких поросят штаммами, которые отличаются от используемых на практике и от применяемых для вакцинации свиноматок смогут, в определенной степени, преодолеть ингибирующий эффект материнских антител. В дополнении, повторяющиеся вакцинации свиноматок альтернативными штаммами скорее всего будут более иммунногенными, чем использование раз за разом одинаковых штаммов. В идеале, имеющийся активный иммунитет также следует рассматривать при планировании схем вакцинации. Действительно, свинки и свиноматки обычно являются зараженными одним или более штаммами SwIV. Имеющийся иммунитет, как было выявлено, увеличивает и во многих случаях расширяет иммунный ответ на мертвую вакцину, особенно если вакцинные штаммы отличаются от тех, которые вызвали инфекцию.
Политика регулярного обновления штаммов вакцин не только непрактична для вакцин против свиного гриппа, у нее есть свои ограничения. Нам не стоит забывать, что успех вакцинации будет зависеть от многих факторов, отличных от соответствия вакцинных штаммов, таких как история заражения гриппом, адъювант и доза антигена в вакцине (Ван Рит и Ма, 2013). Эти прочие факторы кажутся более важными в свиноводстве, нежели в ситуации с людьми.
Выражаем благодарность
В исследованиях гриппа в лаборатории автора помогали Специальный Исследовательский Фонд Гентского университета, Федеральная государственная служба здравоохранения, безопасности пищевых продуктов и охраны окружающей среды Бельгии и Европейская Комиссия.


