B-режим ультрасонографии – широко используемый режим диагностики репродуктивного здоровья особей мужского пола, особенно мужчин. Было доказано, что можно визуализировать семенники, придатки семенников и дополнительные половые железы при определении причин недостаточности репродуктивной функции / бесплодия и при диагностике заболеваний половых путей особей мужского пола. В ветеринарной медицине ультрасонография используется в отношении жеребцов, быков, самцов кроликов, как и собак, но также, хотя и реже, хряков, что будет кратко описано в этой статье.
B-режим ультрасонографии репродуктивного тракта следует выполнять, когда хряк находится в вертикальном положении и в идеале также лишен подвижности. Этого можно достичь, если поместить хряка в специальную клетку или производить сканирование, когда хряк находится на манекене свиноматки для сбора спермы. Другой подход для иммобилизации заключается в том, чтобы поднять кабана с помощью особых, специально разработанных креплений, но это может иметь ограничения, вызванные небольшим анатомическим смещением семенников и их придатков. В некоторых случаях также можно сканировать кабанов в спокойном состоянии после сбора семенной жидкости в комнате для сбора спермы или в то время, когда они находятся в своих загонах.

Существует множество ультразвуковых аппаратов, которые можно использовать для сканирования репродуктивного тракта хряков. Несмотря на то, что в данном документе нет намерения, чтобы отдать предпочтение тому или иному аппарату, авторы приобрели опыт работы с диагностической техникой при использовании устройств, которые с большим успехом обеспечивают высокое разрешение, а именно: HONDA 1600, Fazone CB и Zonare Z-one.
Сканирование дополнительных половых желез должно выполняться трансректально с использованием ультразвукового зонда для линейного сканирования (Кларк и Альтхаус, 2002; рис.1), в то время как для семенника, придатка семенника, а также семенного канатика предпочтительным устройством будет секторный (микро-) выпуклый ветеринарный зонд (рис.2А и В). Использовались частоты от 5,0 до 9,0 МГц, причем более низкие частоты были более подходящими для тканей, которым требовалась более высокая глубина проникновения (т.е. для семенника и тела придатка семенника), а более высокие частоты для достаточно миниатюрных структур, таких как головка придатка семенника и хвост придатка семенника. Таким образом, оптимальный зонд и частота зависят от цели обследования.
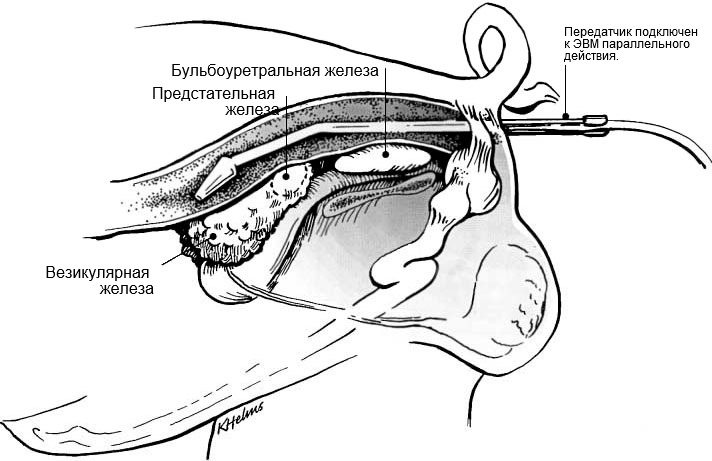
Рис. 1: Размещение держателя с передатчиком в прямой кишке для визуализации дополнительных половых желез хряка (Взято у Кларка и Альтхауса, 2002).Placement of transducer holder with the transducer per rectum for visualization of accessory sex glands of the boar (from Clark & Althouse, 2002).
Перед сканированием семенников, придатков семенников и семенного канатика поверхность мошонки должна быть чистой и, при необходимости, выбрита.
Семенники могут сканироваться либо продольно, либо поперечно (рис. 2А и В). Чтобы определить окружность яичка, необходимо использовать поперечную визуализацию. Здоровая ткань семенников имеет среднюю способность отражения звукового сигнала и имеет гомогенную эхоструктуру, с гиперэхогенной сетью каналов яичка в центре яичка (рис. 3А и В).
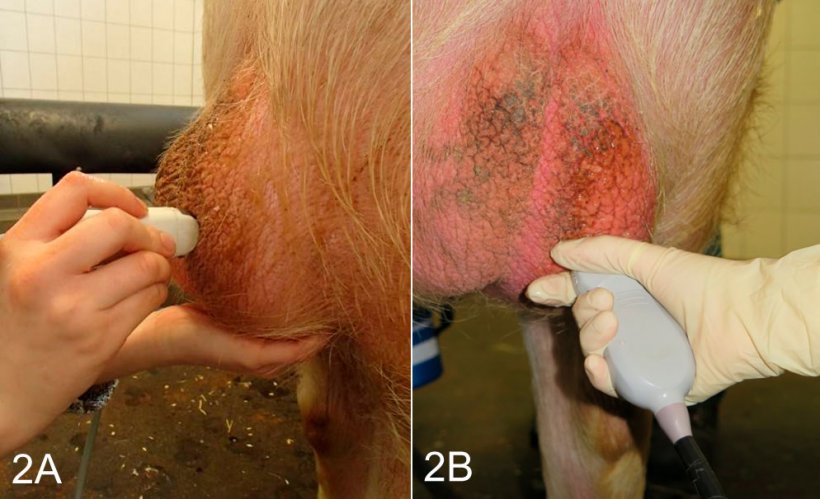
Рис. 2: Процедура сканирования яичка у спокойного хряка в свободном состоянии после сбора семенной жидкости в комнате для сбора спермы. A) Продольное сканирование с использованием микровыпуклого зонда. B) Поперечное сканирование с использованием выпуклого зонда. Эта локация сканирования должна также использоваться при визуализации тела придатка яичка.Procedure of scanning of the testis in a non-restrained calm boar post-ejaculation in the semen collection room. A) Longitudinal scanning using a micro-convex probe. B) Transversal scanning using a convex probe. This scanning location has also to be employed when imaging the epididymal corpus.
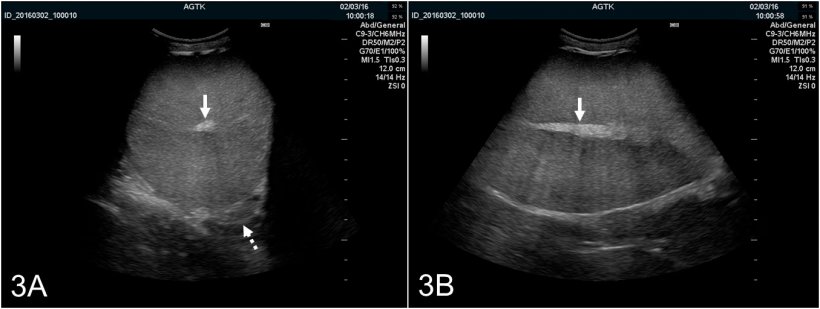
Рис. 3: Ультрасонографические изображения яичка кабана, отсканированного поперечно (A) и продольно (B). Сеть каналов яичка отображается как гиперэхогенное пятно в центре яичка (сплошная стрелка). Паренхима яичка обладает средней эхогенной и однородной эхоструктурой. Поперечная визуализация также обеспечивает оптимальную визуализацию тела придатка яичка (пунктирная стрелка), которое обычно имеет аналогичный ультразвуковой вид, как и само яичко.
Сканирование эпидидимиса должно выполняться в разных положениях в зависимости от того, находится ли головка (от вентральной стороны), тело (в поперечном направлении в середине горизонтальной оси семенника при ручной фиксации яичка) или хвост (от дорсальной стороны во время ручного подталкивания яичка и эпидидимиса снаружи) (рис. 4, Кауффолд и др., 2011).
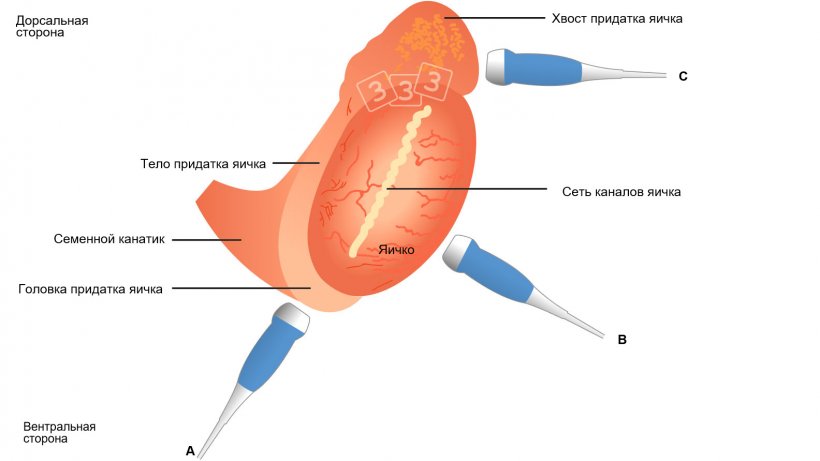
Как правило, эпидидимальная ткань обладает однородной и правильной эхоструктурой, при этом головка и тело эпидидимиса обладают более тонкой, а хвост – в большей степени мраморной эхоструктурой (рис. 5A–C). Однако, эхогенность, которая определяется при «исследовании с использованием серой шкалы» и дается как среднее значение серого, незначительно отличается между тремя сегментами, наряду с изменениями при сравнении изображений, полученных до и после сбора спермы (Кауффолд и др., 2011) у хряка.
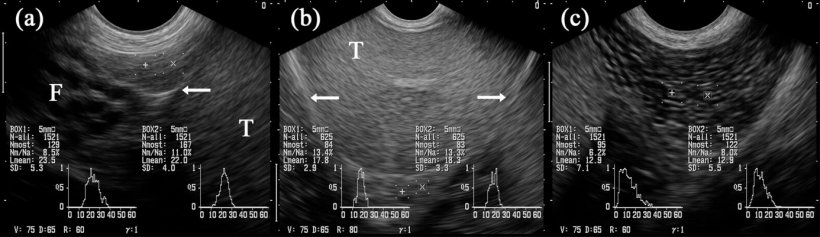
Рис. 5: Ультрасонографические изображения эпидидимальных сегментов: головки придатка яичка (a), тела придатка яичка (b) и хвоста придатка яичка (c). Рамки, обозначенные «+» и «x», проецируются в соответствующие эпидидимальные сегменты. Яичко (T). Рядом с головкой придатка яичка расположены многочисленные трубчатые структуры, идентифицированные как части семенного канатика (F). Стрелки указывают на серозное покрытие семенников (т.е. семенниковую сумку) (Взято у Грахофера, 2011).

Здоровые дополнительные половые железы (например, бульбоуретральная, предстательная и везикулярная железы) были лучше всего описаны Кларком и Альтхаусом (2002) следующим образом: «Парные бульбоуретральные железы лучше всего определяются как длинная овальная железа с однообразным эхогенным свойством с большим безэховым пространством в центре железы, занимающим большую часть ее длины. Стенки везикулярных желез оказались тонкими, с паренхимой, имеющей многочисленные небольшие эхояркие области, которые, как оказалось, сливаются и образуют центральный канал. Предстательную железу лучше всего идентифицировать как железу размером с грецкий орех с однородным эхогенным оформлением». Как было показано для эпидидимиса, состояние всех трех желез изменилось по сравнению с предшествующей эякуляцией настолько, насколько уменьшился «жидкий компонент», а у желез затем появилась более высокая эхогенность.
Исследования по практическому использованию ультрасонографии в сфере репродуктивной функции хряков являются редкими. Диаметр семенников был определен для того, чтобы этот показатель соотнести с общим числом сперматозоидов в эякуляте (Кларк и др., 2003) или оценить половое развитие (Форд и Уайз, 2010). Хотя корреляция парного диаметра семенников и общего количества сперматозоидов была неудовлетворительной, по крайней мере, у хряков, которые были старше 8 месяцев, то определение размера семенников у молодых хряков в возрасте примерно 4-х месяцев оказалось пригодным для прогнозирования тестикулярного объема и, следовательно, ежедневного производства спермы в более старшем возрасте, когда хряк становится половозрелым. Существует недавний отчет относительно бесплодного хряка большой белой породы с мультикистозной дегенерацией бульбоуретральной железы; пораженная железа была отображена с цельными и четко выраженными анэхогенными кистами разного размера (рис.6; Грахофер и др., 2016).

Рис. 6: Изображения бульбоуретральной железы больного хряка, имеющего несколько четко выраженных анахогенных кист разного размера (A), и здорового хряка для сравнения (B) (Грахофер и др., 2016).
Подводя итог, можно сказать, что ультразвуковое исследование репродуктивного тракта хряка является жизнеспособной диагностической методикой, которая может предоставить ценную информацию о функционировании тканей и их здоровье. Не смотря на то, что практическое использование в настоящее время ограничено, автор надеется, что использование этого режима (в дополнение к другим, таким как режим цветового доплера [рис. 7A и B]) получит дальнейшее распространение у занятых в свиноводстве в качестве инструмента, который позволяет прогнозировать потенциальный размер выработки семенной жидкости и точно диагностировать недостаточность репродуктивной функции / бесплодие, что имеет связь с пораженными тканями.
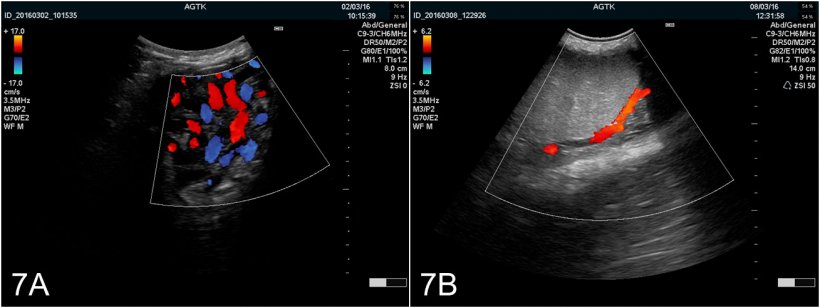
Рис. 7: Изображения яичка, полученные с использованием ультрасонографии в режиме цветового доплера. A) Сосуды семенного канала. B) Яичковая артерия.
Выражение признательности
Авторы благодарят Надю Леглер за ее помощь с созданными изображениями, использованными в этой статье.



