АНАЛИТИЧЕСКИЙ КОНТРОЛЬ АМОКСИЦИЛЛИНА И ЭНРОФЛОКСАЦИНА
В ВЕТЕРИНАРНЫХ ПРЕПАРАТАХ И ПРОБАХ КОРМОВ ДЛЯ СВИНЕЙ
Э. МИРРАЛЕС-КАРДИЕЛЬ1, И. КАЗАЛЬС-РИБЕС2, А. СКРЫЛЬ3,
С. ШАПОВАЛОВ4, Е. КОРНИЛОВА5, А. ПОТЕХИН6
1 специалист лаборатории техники разделения, Государственный Университет Барселоны (Испания),
2 руководитель лаборатории техники разделения, Государственный Университет Барселоны (Испания),
3специалист центра испытания качества кормов и продуктов животного происхождения, Научно-испытательный центр «Черкизово» (Россия),
4 директор, Научно-испытательный центр «Черкизово» (Россия),
5 руководитель центра испытания качества кормов и продуктов животного происхождения, Научно-испытательный центр «Черкизово» (Россия),
6 технический специалист компании «Биокорм Интернешнл С.Л.» (Испания)
АННОТАЦИЯ
Для оценки стабильности кормовых препаратов, содержащих амоксициллин и энрофлоксацин, при процессе грануляции кормов были проведены исследования кормов до и после грануляции, а также ветеринарных препаратов в условиях, имитирующих грануляцию, в лабораториях НИЦ «Черкизово» и Университета Барселоны. Методом ВЭЖХ была определена концентрация амоксициллина и энрофлоксацина в пробах ветеринарных препаратов «Амоксигран» и «Энрогран» компании «Биокорм Интернешнл С.Л.» (Испания), а также в пробах кормов для свиней с добавлением данных препаратов. Средние концентрации амоксициллина в корме с «Амоксиграном» и энрофлоксацина в корме с «Энрограном» до и после гранулирования в исследованиях проведенных как в Испании, так и в России, были выше 90 % и 94 % от теоретического содержания, соответственно, что подтверждает удовлетворительную стабильность активных ингредиентов. Инновационная разработка микрогранулирования препаратов «Амоксигран» и «Энрогран» позволяет эффективно использовать их при производстве гранулированных кормов.
ВВЕДЕНИЕ
Несмотря на прогресс в создании средств специфической профилактики против бактериальных болезней, поголовье свиней зачастую оказывается не защищено из-за недостаточной длительности напряженного иммунитета в результате вакцинации, проводимой после отъема. Применение антибактериальных средств поголовью с тем, чтобы предупредить экономические потери из-за инфекций бактериальной природы, представляется оправданным. Использование лекарственных препаратов с кормом ‒ наиболее приемлемый вариант, так как можно обрабатывать большие группы животных без воздействия на них стресс-факторов и с минимальными затратами труда.
К числу наиболее часто применяемых в свиноводстве антибактериальных препаратов с кормом относят антибиотики группы пенициллинов и фторхинолонов, к которым относятся амоксициллин и энрофлоксацин, обладающих широким спектром бактерицидного действия. При этом используемые препараты должны соответствовать всем требованиям кормопроизводства, а именно, обладать следующими свойствами: термостабильность – устойчивость к воздействию высоких температур при грануляции корма; совместимость с компонентами корма, за счет тщательно подобранных вспомогательных веществ; защита от воздействия факторов внешней среды, таких, как температура, влажность, естественное содержание кислорода воздуха и УФ-лучи. Также учитывается высокая степень сыпучести, отсутствие электростатических свойств и оптимальный размер гранул (0,3-0,7 мм).
В ряде работ показано, что амоксициллин эффективен при лечении стрептококкоза и гемофилезного полисерозита свиней (Higgins and Gottschalk 2006; Rapp-Gabrielson et al. 2006). Большинство штаммов Streptococcus suis и Haemophilus parasuis, выделенные из свиней проявляют высокую чувствительность к препарату (Marie et al. 2002; Pejsak et al. 2005; Schwarz et al 2007, 2008). При пероральном введении амоксициллин быстро всасывается из желудочно-кишечного тракта и проникает в большинство органов и тканей животного.
Однако, амоксициллин, как и другие пенициллины, известен своей нестабильностью по отношению к колебаниям pH, температуры, давления и влажности, возникающим при гранулировании кормов, а также во время хранения. Это отрицательное свойство препарата является основным препятствием его эффективного использования в составе гранулированных кормов. Кроме инактивации амоксициллина в процессе грануляции на стабильность препарата большое влияние оказывает и состав корма. Таким образом, при изготовлении лекарственного корма специалисты по животноводству и кормлению сталкиваются с проблемами стабильности активного ингредиента. В связи с этим были разработаны различные способы защиты амоксициллина (инкапсуляция) от влияния воздействий внешней среды (Derrieu et al. 2000; Bousquet et al. 2006).
Фторхинолоны, в частности энрофлоксацин, широко используют для лечения различных респираторных, желудочно-кишечных и урогенитальных заболеваний свиней, вызываемых грамотрицательными и грамположительными бактериями, а также микоплазмами. Энрофлоксацин частично метаболизируется в печени с образованием ципрофлоксацина, также обладающего антибактериальной активностью. При этом убой свиней на мясо разрешается не ранее, чем через 5 суток после применения препарата (Trouchon et al. 2016).
Для качественного и количественного анализа амоксициллина и энрофлоксацина в лекарственных формах и кормах в настоящее время используют метод ВЭЖХ с различными способами детектирования (Peddi et al. 2016; Zemanova et al. 2008).
Целью данного исследования было определение концентрации амоксициллина и энрофлоксацина методом ВЭЖХ в промышленных партиях кормов с добавлением коммерческого препарата «Амоксигран» и ряда других препаратов с амоксициллином, а также препарата «Энрогран», до и после гранулирования при различных температурах. Кроме того, проводили контроль концентрации амоксициллина в коммерческом препарате «Амоксигран» и нескольких других препаратов с амоксициллином при проведении лабораторного эксперимента, имитирующего условия грануляции.
МАТЕРИАЛЫ И МЕТОДЫ
АМОКСИЦИЛЛИН
Стандартные образцы. Для проведения исследований был использован сертифицированный стандарт амоксициллина тригидрата (CAS: 61336-70-7), полученный от Sigma-Aldrich.
Стандартные растворы. Основной стандартный раствор амоксициллина (1 мг/см3) был приготовлен путем растворения навески в смеси вода/метанол 80/20 v/v. При расчете концентрации учитывались чистота стандарта и содержание амоксициллина основания в молекуле амоксициллина тригидрата. Пять калибровочных растворов с концентрацией амоксициллина от 10 до 200 мкг/см3, готовили ex tempore путем соответствующих разбавлений аликвот основного раствора буферным раствором (рН=6,0).
Экстракция.
Образцы кормов. Перед анализом все образцы кормов были размолоты с использованием центрифужной мельницы (Retsch ZM 200) с ситом 1 мм (НИЦ «Черкизово») и криогенной мельница SPEX модель 6850 (университет Барселоны). Каждый анализ проводили в двух повторностях. К 25 г каждого образца размолотого корма добавляли по 50 см3 хлороформа, тщательно перемешивали и экстрагировали на ультразвуковой бане в течение 15 мин. После этого в смеси добавляли по 100 см3 буферного раствора и продолжали экстракцию на горизонтальном шейкере при 200 об/мин в течение 30 мин. Затем весь объем полученной смеси переносили в центрифужные пробирки объемом 50 см3 и центрифугировали при 3000 об/мин в течение 15 мин. Полученный над-осадок из каждой соответствующей пробирки объединяли и фильтровали через шприцевой нейлоновый фильтр 0,45 мкм.
Ветеринарные препараты. В работе использовали коммерческий препарат «Амоксигран» компании «Биокорм Интернешнл С.Л.» в виде премикса (А), включающего 15% амоксициллина тригидрата в форме микрокапсулированного порошка и эксципиент (кормовая основа). Коммерческие препараты в виде премиксов (B) и (С) содержали в составе 10% и 20% нативного амоксициллина тригидрата, соответственно. К 2 г каждого ветеринарного препарата добавляли около 190 см3 метанола и экстрагировали на ультразвуковой бане в течение 30 мин. После остывания экстракта до комнатной температуры, объем доводили метанолом до 200 см3. Аликвоту объемом 1 см3 переносили в мерную колбу объемом 10 см3 и доводили объем до метки буферным раствором. Полученный экстракт фильтровали через шприцевой нейлоновый фильтр 0,45 мкм.
Проведение ВЭЖХ-УФ анализа. Система, состоящая из автосамплера S 5300 (SYKAM, Germany), насоса S 1130 (SYKAM, Germany) и диодно-матричного детектора S 3350 (SYKAM, Germany) была использована для исследования в НИЦ «Черкизово», и жидкостной хроматограф Wathers Alliance 2695, детектор DAD Waters 2996 были использованы в университете Барселоны. Длина волны для анализа препаратов и кормов составляла 228 и 240 нм, соответственно. Изократическое элюирование осуществлялось для препаратов, и градиентное для кормов на хроматографической колонке Mediterranea Sea 18,5 µm, 25x0,46 cm, Teknokroma (НИЦ «Черкизово») и Ultrabase 100 (Akady Cromatografia; 4,6×100 мм; размер частиц 3,0 мкм (университет Барселоны). В изократическом режиме подвижная фаза состояла из смеси 0,15%-го водного раствора фосфорной кислоты, доведенного до рН=2,6 раствором гидрооксида натрия 0,1 М и метанола в соотношении 80/20 v/v. В градиентном режиме элюирования вышеуказанные растворы были разделены в две банки (А - раствор фосфорной кислоты) и (В - метанол). Градиентная программа представлена в таблице 1.
Таблица 1 - Градиентная программа растворов фосфорной кислоты и метанола
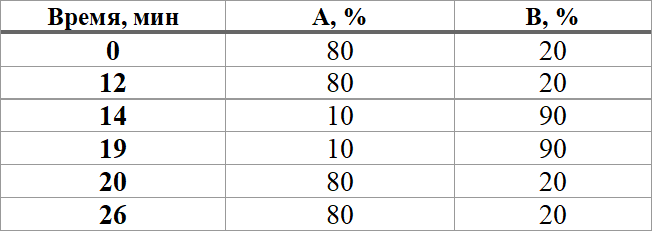
Анализ проводился при потоке 0,8 мл/мин, объем инжекции составил 20 мкл.
ЭНРОФЛОКСАЦИН
Стандартные образцы. Для проведения исследований был использован сертифицированный стандарт энрофлоксацина (CAS: 93106-60-6), полученный от Sigma-Aldrich
Стандартные растворы. Основной стандартный раствор энрофлоксацина (100 мг/см3) был приготовлен путем растворения навески в экстракционном растворе (0,1 М натрий фосфатный буфер с рН 7,4/этанол 60/40 v/v). При расчете концентрации учитывали чистоту стандарта. Пять калибровочных растворов с концентрацией энрофлоксацина от 0,5 до 10 мкг/см3 готовили ex tempore путем соответствующих разбавлений аликвот основного раствора раствором для экстракции.
Экстракция. Перед анализом все образцы кормов были размолоты с использованием центрифужной мельницы (Retsch ZM 200) с ситом 1 мм. Каждый анализ проводили в двух повторностях. К 5 г каждого образца размолотого корма в баночке из боросиликатного стекла объемом 100 см3, добавляли по 50 см3 экстракционного раствора и экстрагировали на горизонтальном шейкере при 350 об/мин в течение 60 мин. Затем 2 см3 полученного экстракта переносили в микроцентрифужные пробирки объемом 2 см3 и центрифугировали при 14500 об/мин в течение 5 мин. Полученный над-осадок фильтровали через шприцевой полиэфирсульфоновый фильтр 0,2 мкм.
Проведение ВЭЖХ-УФ анализа. Была использована система, состоящая из автосамплера S 5300 (SYKAM, Germany), насоса S 1130 (SYKAM, Germany) и флуоресцентного детектора RF-20A Prominence (Shimadzu). Длина волны возбуждения и эмиссии составляла 280 и 465 нм, соответственно. Градиентное элюирование осуществлялось на хроматографической колонке Reprosi-Pur Basic C18, 5 µm, 15x0,46 cm, Dr.Maisch с предколонкой ReproSil-Pur Basic-C18, 5 µm 10x4,6 mm.
Растворы подвижных фаз А (фосфорная кислота 2,9 г/л (1,75 мл/л) доведенная до рН=2,3 триэтиламином) и В (ацетонитрил) были разделены в две банки. Градиентная программа представлена в таблице 2.
Таблица 2 - Градиентная программа растворов фосфорной кислоты и ацетонитрила
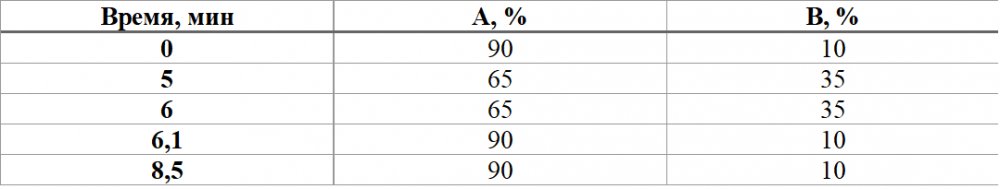
Анализ проводился при потоке 1,5 мл/мин, объем инжекции составил 5 мкл.
Все испытания были проведены согласно вышеописанным методикам.
РЕЗУЛЬТАТЫ
Результаты определения содержания амоксициллина в пробах премиксов, подвергнутых воздействию различных температур, представлены в таблице 3.
Таблица 3 - Стабильность концентрации амоксициллина в пробах премиксов при воздействии различных температур
Представленные в таблице 3 результаты свидетельствуют, что температурная обработка премиксов приводила к снижению концентрации активного ингредиента. При этом наибольшую степень инактивации амоксициллина наблюдали при обработке проб при максимальной температуре. Премикс (А) обладал наибольшей термостабильностью, при этом потеря концентрации активного ингредиента составила 1,7%. В тоже время у премиксов (В) и (С) снижение аналогичного показателя наблюдали на 14,7% и 11,3%, соответственно.
Помимо результатов, показывающих, насколько стабилен каждый из препаратов при нагревании, важно обратить внимание на полученное содержание амоксициллина в образцах до нагрева. В препаратах А, В и С заявленное содержание 15, 10 и 20% (или 150, 100 и 200 мг/г), соответственно. Как видно из таблицы, содержание амоксициллина в препаратах А и В соответствует заявленному (149,5 и 98,4 мг/г, соответственно). Однако содержание действующего вещества в препарате С значительно отличается от заявленного производителем – 167,9 мг/г из заявленных 200 мг/г. Все три препарата содержат амоксициллин в форме тригидрата. Амоксициллин тригидрат (молекулярная масса 419,5 г/моль, (PubChem) содержит 87,1 % амоксициллина основания (молекулярная масса 365,4 г/моль, (PubChem). Терапевтическая доза препарата рассчитывается из количества чистого амоксициллина, а не амоксициллина тригидрата. Учитывая это, производители препаратов А и В положили в свои формулы такое количество амоксициллина тригидрата, чтобы количество амоксициллина в них соответствовало заявленному - 150 и 100 мг/г, соответственно. Если пересчитать содержание амоксициллина в препарате С (167,9 мг/г) на амоксициллин тригидрат, то получится 192,8 мг/г, что гораздо ближе к заявленным 200 мг/г. Согласно инструкции по применению препарата С, он и должен содержать 200 мг/г амоксициллина тригидрата. При этом при расчете дозировки упоминается, что дозу рассчитывают из содержания амоксициллина. Естественно, данный пересчет не включен в инструкцию. Более того, персонал, составляющий рецептуру корма и ответственный за норму ввода препарата в корм, также не осведомлен о подобных нюансах, так как не имеет химико-фармацевтического образования. Вследствие этого, несмотря на то, что препарат дозируют в соответствии с инструкцией, количество действующего вещества в корме получается заниженным, что значительно влияет на производство конечного продукта. Таким образом, при выборе препарата, особенное внимание следует обращать на то, какое количество амоксициллина основания содержит продукт.
Анализ ВЭЖХ, используемый в данном исследовании, был разработан лабораторией университета Барселоны на основе эталонного метода анализа амоксициллина (European Pharmacopoeia, 2005), модифицированного оригинальной процедурой экстракции, адаптированной к образцам корма. Результаты определения содержания амоксициллина в 6 пробах кормов, до грануляции и после грануляции при температурах от 70оС до 90оС в течение 5 мин, проведенного в Университете Барселоны, представлены в таблице 4.
Таблица 4 - Стабильность концентрации амоксициллина в пробах кормов с препаратом «Амоксигран» при воздействии различных температур
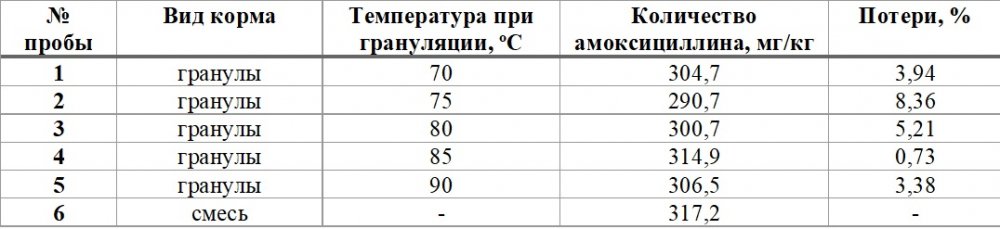
При этом выявленные различия в концентрации антибиотика в гранулированном корме и муке были значительно ниже стандартных отклонений концентраций в пределах каждого вида корма (Р > 0,05).
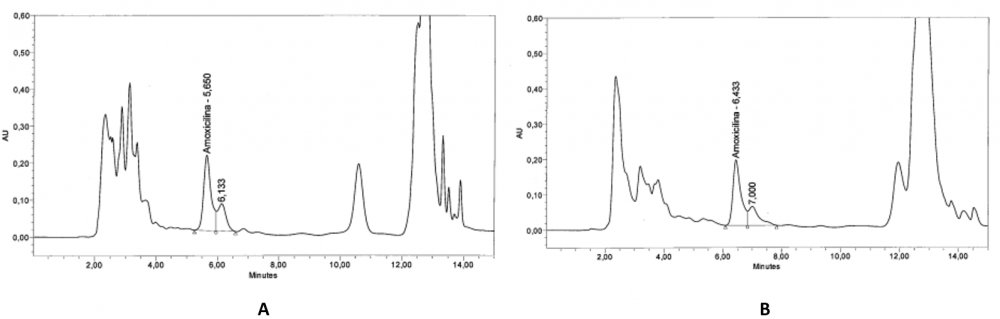
Рис.1 Хроматограммы, полученные при анализе образцов корма на содержание амоксициллина: А – корм до грануляции, В – корм после грануляции при 70оС, С – корм после грануляции при 75оС, D – корм после грануляции при 80оС, E – корм после грануляции при 85оС, F - корм после грануляции при 90оС
В рамках контроля терапевтических доз ветеринарных препаратов в НИЦ «Черкизово» было проведено исследование стабильности двух коммерческих препаратов, содержащих амоксициллин как действующее вещество, одним из которых был «Амоксигран». Эксперимент был построен аналогично описанному выше исследованию, проведенному в Университете Барселоны. Оба препарата вводили в корм в одинаковой дозировке, чтобы получить 200 ppm действующего вещества, и затем проводили исследование кормов до и после грануляции на содержание амоксициллина. Параметры грануляции кормов были следующими – температура 62,5 ± 2,5 °С, продолжительность выдержки 45 сек, давление пара 1-1,5 бар. Результаты исследований представлены в таблице 5.
Таблица 5 - Стабильность концентрации амоксициллина в пробах кормов, содержащих препарат А («Амоксигран») и препарат В
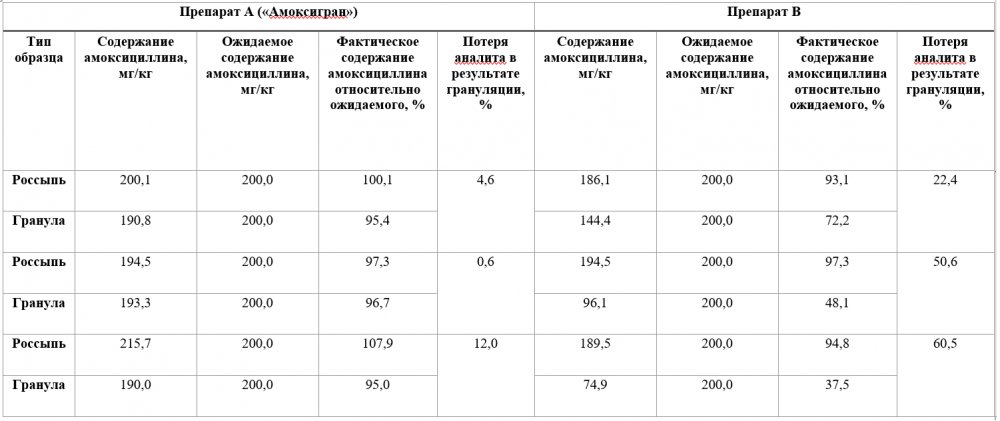
Результаты, приведенные в таблице 5, указывают на важность исследования кормов на содержание действующего вещества до и после грануляции при использовании термолабильных субстанций. Содержание амоксициллина в пробах корма с препаратом А («Амоксигран») до грануляции находилось в диапазоне от 97 до 108% от ожидаемого значения. При этом потери амоксициллина в результате грануляции корма составили 0,6-12%, что, помимо самой грануляции, частично может быть связано с погрешностью метода исследования. Пробы корма до грануляции с ветеринарным препаратом В в составе содержали от 93 до 97% амоксициллина от ожидаемого значения. После грануляция потери аналита составили 22-60%, что указывает на нестабильность молекулы амоксициллина в данном ветеринарном препарате.
С целью определения стабильности препарата «Энрогран» на комбикормовых заводах одного из крупнейших предприятий России при его использовании ежемесячно отбирали образцы кормов до и после грануляции с трех разных заводов предприятия. Анализ проводили в НИЦ «Черкизово». Параметры грануляции кормов были следующими – температура 82,5±2,5 °С, продолжительность выдержки 45 сек, давление пара 1-1,5 бар. Результаты, полученные за 6 месяцев использования препарата, представлены в таблице 6.
Таблица 6 - Стабильность концентрации энрофлоксацина в пробах кормов, содержащих препарат «Энрогран»
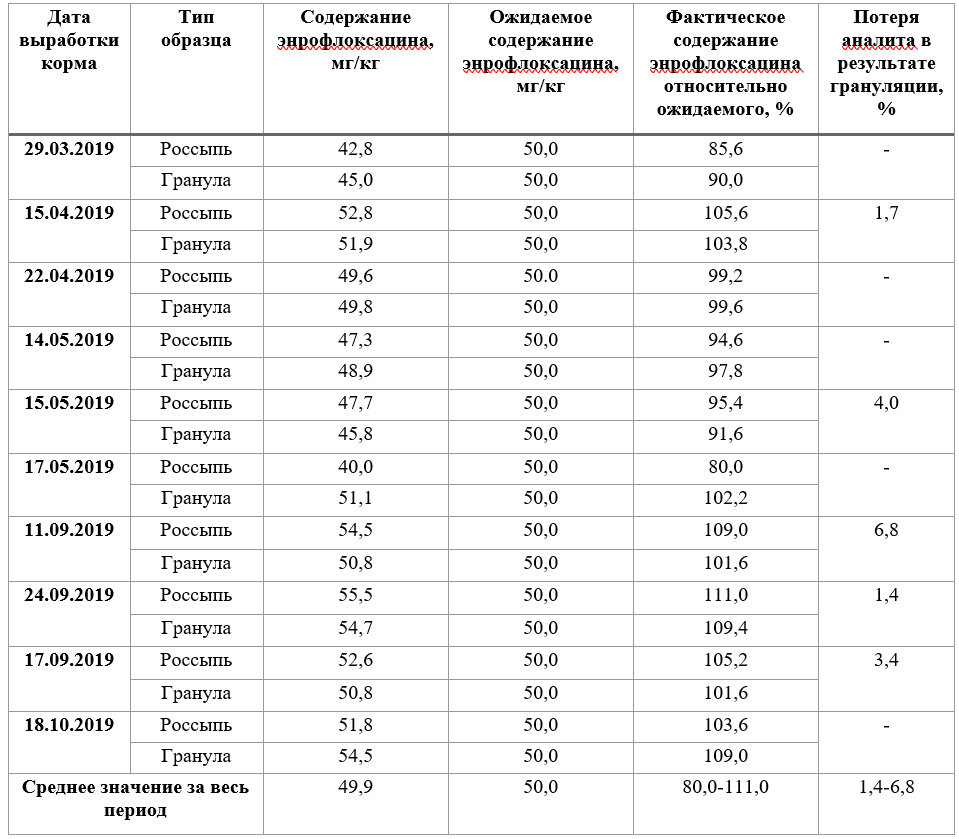
Рис. 2 Хроматограммы, полученные при анализе образцов кормов на содержание энрофлоксацина.
А – корм до грануляции; В – корм после грануляции; С – калибровочные растворы
Из данных, приведенных в таблице 6, видно, что фактическое содержание энрофлоксацина в корме варьировалось от 80 до 111% от ожидаемого содержания, при этом, большая часть результатов (18/20) была в диапазоне 90-111%. Потери аналита при грануляции, определенные, как разница между результатом до и после грануляции, отнесенная к результату до грануляции, составили не более 6,8%. Полученные результаты исследований препарата «Энрогран» показывают его стабильность в кормах после грануляции и однородность препарата от партии к партии.
ОБСУЖДЕНИЕ
Полученные результаты экспериментов по стабильности препаратов разных производителей в процессе грануляции указывают на очевидную важность проведения таких экспериментов для принятия решения о том, какой препарат сохранит свою активность в конечном продукте – гранулированном корме. Каждый производитель имеет свою уникальную технологию защиты молекулы действующего вещества в препарате, нацеленную на предотвращение деградации активной фармацевтической субстанции из за таких факторов как окисление, термо- и фотодеградация и др. Однако же, в процессе грануляции есть много факторов, таких как высокая температура, повышенное давление, и, как следствие, возможны химические реакции между действующим веществом и другими компонентами корма или премикса, которые могут отрицательно повлиять на содержание действующего вещества в конечном продукте. К тому же условия грануляции на разных заводах и для разных марок кормов могут значительно отличаться, из-за чего невозможно однозначно сказать, произойдет ли деградация действующего вещества или нет. Подобные эксперименты крайне важны для термолабильных молекул с известной нестабильностью при воздействии высоких температур, таких, как амоксициллин. Аналогичный тип аналитического метода был ранее описан для анализа амоксициллина в лекарственных премиксах (Dousa and Hosmanová 2005).
ВЫВОДЫ
1. Испытанная в эксперименте концентрация кормового амоксициллина соответствует рекомендуемому уровню, эквивалентному режиму дозирования 10-15 мг/кг, что эквивалентно 0,67-1,0 г «Амоксиграна» на 10 кг массы тела в сутки. Такая терапевтическая концентрация согласуется с фармакодинамикой амоксициллина против Streptococcus suis и Haemophilus parasuis (Schwarz et al. 2008).
2. Разница между средними концентрациями амоксициллина в пробах до и после грануляции муки и гранулированных кормов составляла от 0,73% до 8,36%. В других исследованиях, где в составе корма использовали нативный амоксициллин, соответствующая разница была значительно выше и достигала 20-40% (Derrieu et al. 2000, Bousquet et al. 2006).
3. Результаты экспериментов по анализу кормов до и после грануляции, проведенные как в Университете Барселоны, так и в НИЦ «Черкизово», показали хорошую стабильность препарата «Амоксигран» при воздействии различных температур в процессе грануляции (максимум 90оС), при этом потери не превышали 12,0%. В тоже время результаты по содержанию амоксициллина в кормах до и после грануляции, содержащих ветеринарный препарат А, полученные в НИЦ «Черкизово», показали неудовлетворительную стабильность последнего, с потерями до 60,5% в гранулированном корме.
4. Исследование кормов российского производителя, содержащих ветеринарный препарат «Энрогран», также показали хорошую стабильность энрофлоксацина в процессе грануляции, а также однородность самого препарата от партии к партии, так как исследование было проведено в течение 5-ти месяцев и образцы отбирались ежемесячно с разных комбикормовых заводов.
5. Испытанная в эксперименте концентрация кормового энрофлоксацина соответствует рекомендуемому уровню при режиме дозирования 2,5-5,0 мг/кг, что эквивалентно 0,25-0,5 г «Энрограна» на 10 кг массы тела в сутки. Такая терапевтическая концентрация согласуется с фармакодинамикой энрофлоксацина против Actinobacillus pleuroneumoniae и Salmonella spp (Zhixin Lei et al. 2017, Haihong Hao et al. 2015).
6. Стабильность амоксициллина и энрофолсацина в коммерческих препаратах «Амоксигран» и «Энрогран» компании «Биокорм Интернешнл С.Л.», представленных в виде микрокапсулированных порошков, обеспечивается наличием многослойных защитных оболочек гранул.
БИБЛИОГРАФИЯ
Bousquet E, Derrieu G, Raynier B, Segot C, Lemaire F, Sanquer A, Casado P, Coll Masvidal T, Morillo Alujas A, Cano Lopez G, Villalba Mata D, Goutalier J, Combeau S 2006: Comparative study of different amoxicillin premixes (homogeneity and stability in feed). In: 27th Anaporc Symposium. Badajoz, Spain, pp. 185-188.
Derrieu G, Raynier B, Ascher A, Gardey L 2000: Interest of a stabilized amoxicillin in feedstuffs manufacturing. Rev Med Vet 151: 109-117
Dousa M, Hosmanova R 2005: Rapid determination of amoxicillin in premixes by HPLC. J Pharm Biomed Anal 37: 373-377
European Pharmacopoeia 2005: Amoxicillin trihydrate. In: European Pharmacopoeia, supplement 5.3. 5th ed. European Directorate for the Quality of Medicines and Healthcare, Strasbourg, pp. 3440-3442
Higgins R, Gottschalk M 2006: Streptococcal diseases. In: Straw B, Zimmerman JJ, D’Allaire S, Taylor DJ (Eds): Diseases of Swine. Blackwell Publishing, pp. 767-783
Marie J, Morvan H, Berthelot-Herault F, Sanders P, Kempf I, Gautier-Bouchardon AV, Jouy E, Kobisch M 2002: Antimicrobial susceptibility of Streptococcus suis isolated from swine in France and from humans in different countries between 1996 and 2000. J Antimicrob Chemother 50: 201-209
Haihong Hao, Huafang Pan, Ijaz Ahmad, Guyue Cheng, Yulian Wang, Menghong Dai, Yanfei Tao, Dongmei Chen, Dapeng Peng, Zhenli Liu, Lingli Huang, Zonghui Yuan 2013 Susceptibility Breakpoint for Enrofloxacin against Swine Salmonella spp. Clinical Veterinary Microbiology 51(9): 3070-3072
Peddi P., Rajeswari T., Ganji R. 2016: Development and Validation of Stability Indicating RP-LC Method for Estimation of Related Substances of Enrofloxacin in Bulk and Its Pharmaceutical Formulations. Research Journal of Pharmaceutical, Biological and Chemical Sciences 7(1): 1440-1450
Pejsak Z, Jablonski A, Zmudzki J 2005: Drug sensitivity of pathogenic bacteria isolated from the respiratory system of swine. Med Wet 61: 664-668
Rapp-Gabrielson VJ, Oliveira SR, Pijoan C 2006: Haemophilus parasuis. In: Straw B, Zimmerman JJ, D’allaire S, Taylor DJ (Eds.): Diseases of swine. Blackwell Publishing, pp. 681-690
Schwarz S, AlEesik E, Grobbel M, Lubke-Becker A, Werckenthin C, Wieler LH, Wallmann J 2007: Antimicrobial susceptibility of streptococci from various indications of swine, horses, dogs and cats as determined in the BfT-GermVet monitoring program 2004-2006. Berl Munch Tierarztl Wochenschr 120: 380-390
Schwarz S, Bottner A, Goosens L, Hafez HM, Hartmann K, Kaske M, Kehrenberg C, Kietzmann M, Klarmann D, Klein G, Krabisch P, Luhofer G, Richter A, Schulz B, Sigge C, Waldmann KH, Wnllmann J, Werckenthin C 2008: A proposal of clinical breakpoints for amoxicillin applicable to porcine respiratory tract pathogens. Vet Microbiol 126: 178-188
Trouchon T., Lefebvre S. 2016 Review of Enrofloxacin for Veterinary Use, Open Journal of Veterinary Medicine, 6 (2).
Zemanova M., Maxa J., Hera A., Haas Z., Lemaire F., Sanquer A., Bousquet E. 2008 Analytical Control of a Starter Pig Feed Medicated with Amoxicillin. Acta Vet. Brno 77: 341–345
Zhixin Lei, Qianying Liu, Bing Yang, Jincheng Xiong, Kun Li, Saeed Ahmed, Liping Hong, Pin Chen, Qigai He and Jiyue Cao 2017 Clinical Efficacy and Residue Depletion of 10% Enrofloxacin Enteric-Coated Granules in Pigs. Frontiers in Pharmacology 8: 1-11
Добро пожаловать в 333
Подключайтесь, делитесь и взаимодействуйте с крупнейшим сообществом профессионалов в свиноводстве.
Отмечаем 138801 Пользователей 333!
регистрацияУже вступили в сообщество?




